Arten von Fluoreszenzmikroskopen
Als um 1600 u. Z. Mikroskope erfunden wurden, richteten Naturphilosophen ihre Augen auf eine Welt in einer Welt. Als Antony van Leeuwenhoek kleine, stark gewölbte Linsen und einen mechanischen Halter zur Einstellung des Blickwinkels herstellte, öffnete er ein Fenster in die mikroskopische Welt der Bakterien, Blutkörperchen, Protozoen und der Zellstruktur von Pflanzen. Aber in der Geschichte der Mikroskopie gab es immer eine Frage: Was sind diese seltsamen Dinge, die durch eine Linse gesehen werden? Fluoreszenzmikroskopie bezieht sich auf eine Reihe von Techniken, die diese Unsicherheit minimieren – denn in der Fluoreszenzmikroskopie strahlt Licht auf eine Probe, die ihr eigenes Licht direkt zurückstrahlt.
Epifluoreszenz

Das bei weitem gebräuchlichste Fluoreszenzmikroskop ist die Epifluoreszenz-Konfiguration. In einem Epifluoreszenzmikroskop scheint eine Lichtquelle – typischerweise eine Quecksilber- oder Xenonlampe – durch einen Filter, der einen schmalen Wellenlängenbereich auswählt. Das gefilterte Licht fällt durch das Mikroskopobjektiv auf die Probe. Das einfallende Licht wird von Fluorophoren absorbiert – molekularen Markierungen, die Licht einer langen Wellenlänge emittieren, wenn sie Licht einer kürzeren Wellenlänge absorbieren. Licht von den Fluorophoren geht zusammen mit Streulicht von der Beleuchtungsquelle zurück in die Objektivlinse und zum Detektor oder Auge. Unterwegs blockiert ein weiterer Filter das Beleuchtungslicht, sodass nur noch das Fluoreszenzlicht der Probe übrig bleibt.
Konfokal
Ein Epifluoreszenzmikroskop sammelt Licht von überall im Sichtfeld des Mikroskops. Ein Teil des Anregungslichts wird vor der Fokusebene des Mikroskops absorbiert, ein Teil in der Fokusebene und ein Teil jenseits der Fokusebene. Da das Mikroskop all dieses Licht sammelt, enthält das Bild ein scharfes Lichtbild im Fokus, aber auch unscharfes Licht aus anderen Bereichen. Ein konfokales Mikroskop behebt dies, indem ein Laserspot in derselben Ebene fokussiert wird, in der das Mikroskop fokussiert wird. Dann geht eine Lochblende vor den Detektor, wo sie alles Licht blockiert, das nicht aus dem Fokus des Mikroskops kommt. Durch Abtasten der Probe kann ein sauberes dreidimensionales Bild des Objekts erhalten werden.
Multiphotonen
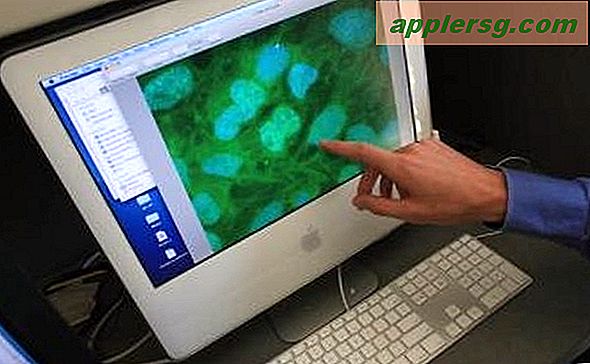
In einem konfokalen Mikroskop ist die Ausrichtung sehr empfindlich. Wenn der Laserspot, das Mikroskopobjektiv, die Sammeloptik und die Lochblende auch nur geringfügig daneben liegen, leidet die Mikroskopleistung. Ein Multiphotonenmikroskop umgeht dieses Problem, indem es eine Laserwellenlänge verwendet, die nur halb so energiereich ist, wie sie sein müsste, um die Fluorophore in der Probe anzuregen. Die Fluorophore können nur angeregt werden und fluoreszieren, wenn das Laserlicht hell genug ist, so dass in kürzester Zeit zwei Lichtteilchen – Photonen – auf den Fluorophor treffen. Das passiert nur, wenn der Laser auf einen sehr kleinen Punkt fokussiert wird. Die einzige Stelle in der Probe, die Licht emittiert, ist also die Stelle, an der der Laser fokussiert ist, wodurch das Bild schön und sauber bleibt, da kein zusätzliches Hintergrundlicht entfernt werden muss – was bedeutet, dass keine Nadellöcher ausgerichtet werden müssen.
Totale interne Reflexionsfluoreszenz (TIRF)
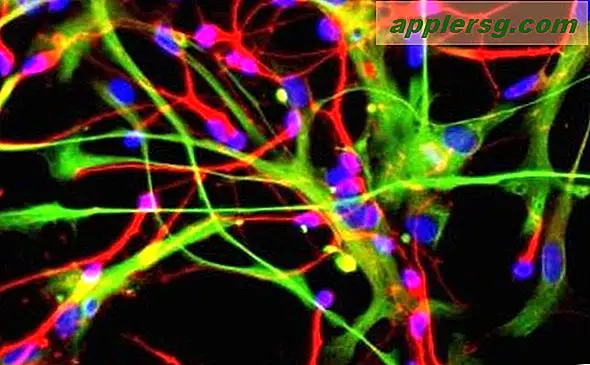
Eine andere Möglichkeit, sehr saubere Bilder zu erhalten, besteht darin, sicherzustellen, dass das Anregungslicht nicht sehr weit in die Probe eindringt. Wenn beispielsweise ein Klecks von Neuronen in einen Lösungstropfen auf einem Glasobjektträger gegeben wird, haften einige der Neuronen an der Glasoberfläche. In einem Total Internal Reflection Fluorescence (TIRF)-Mikroskop wird das Licht seitlich in den Objektträger gelenkt, sodass es nicht wirklich in die Lösung mit den Zellen gelangt. Aber ein Teil des Lichts dringt nur knapp in die Lösung ein – nur sehr nahe an der Oberfläche des Glases. Dies bedeutet, dass die einzigen Stellen, an denen Licht emittiert wird, in einem sehr dünnen Bereich direkt an der Glasoberfläche liegen. Für so etwas wie Neuronen, bei denen so viel Interessantes auf der Oberfläche der Zellen passiert, kann diese Technik sehr effektiv sein.
Super-Auflösung
Alle Mikroskope – einschließlich Fluoreszenzmikroskope – sind durch die Physik begrenzt, die die Lichtausbreitung regelt. Eine der Grundregeln ist, dass ein fokussierter Lichtfleck nur so klein werden kann – und nicht kleiner. Für sichtbares Licht beträgt diese Größe etwa 200 Nanometer oder 200 Milliardstel Meter. Da einzelne Moleküle jedoch nur wenige Nanometer groß sind, gibt es viele interessante Merkmale, die unterhalb dieser Größengrenze, der sogenannten Beugungsgrenze, liegen. Wissenschaftler entwickeln "Super-Resolution"-Techniken, um diese Grenze zu umgehen. Die strukturierte Beleuchtungsmikroskopie (SIM) und die stimulierte Emissionsverarmung (STED) sind beispielsweise beide Fluoreszenzmikroskopieverfahren, die die Größe des Lichtemissionsflecks durch Verkleinern der Größe des Anregungslichtflecks begrenzen.









![iOS 5.0.1 veröffentlicht [Links herunterladen]](http://applersg.com/img/ipad/783/ios-5-0-1-released.jpg)
